Covid-19 et embolie pulmonaire : découverte majeure au CHRU de Besançon

L’hôpital de Besançon est au centre des attentions depuis la publication d’un article scientifique de portée mondiale. Salués par la profession, ces travaux prônent un changement de pratique en termes d’examen thoracique, en détaillant des liens jusqu’alors méconnus entre coronavirus et embolie pulmonaire. Le Pr Eric Delabrousse nous explique.
Le Pr Delabrousse fait partie de l’équipe de radiologie du CHRU de Besançon qui, avec le Pr Sébastien Aubry et les Dr Franck Grillet, Julien Behr et Paul Calame, a publié un article scientifique de portée mondiale, dans la prestigieuse revue américaine RADIOLOGY. La Bible en la matière.
Si la guerre médicale engagée contre le Covid-19 est loin d’être gagnée, leur étude vient d’éclairer la recherche sur ce satané virus, qui garde ses parts de mystère.
Quel constat initial ?
Pour la faible proportion de malades symptomatiques développant la forme pulmonaire du coronavirus, un examen était jusqu’alors systématiquement pratiqué : le scanner thoracique. Ses résultats permettent de quantifier la part des poumons infectés.
Problème : « Les images montraient parfois des poumons peu atteints, alors que l’état du patient nécessitait de la réanimation, une intubation, et débouchait parfois sur un décès », résume le Pr Delabrousse. Les facteurs de comorbité associés – diabète, obésité, hypertension, etc. – expliquent en partie cet écart théorique, mais de nombreux chercheurs tentent d’aller plus loin.
Quelle hypothèse ?
« Il y a deux raisons d’être hypoxique (en manque d’oxygène, NDLR) : c’est soit ventilatoire, soit vasculaire », rappelle le professeur… Le moteur, ou les tuyaux. Comme d’autres praticiens dans le monde, l’équipe médicale bisontine a donc exploré la piste de l’embolie pulmonaire. Il faut pour ce faire changer le paradigme alors en vigueur, et remplacer le scanner thoracique classique – qui ne permet pas de détecter une éventuelle embolie – par un angioscanner, qui utilise des produits de contraste.
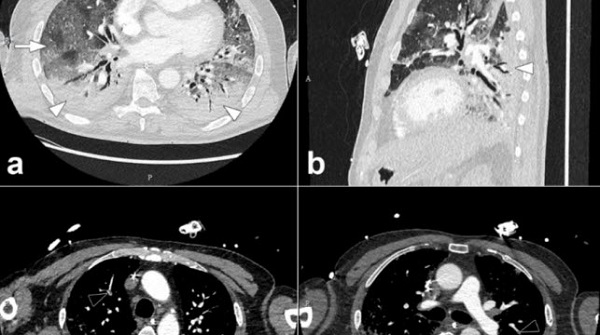
L’article de l’équipe bisontine de radiologie est qualifié de « princeps », un terme technique qui met en avant son côté précurseur. Photo DR/revue scientifique RADIOLOGY
Quel résultat ?
Il est sans appel. Sur 100 patients suspectés de pneumonie liée au Covid-19, 23 souffraient également d’une embolie pulmonaire. « C’est une proportion colossale », tranche le Pr Delabrousse.
L’article bisontin signé dans la revue RADIOLOGY apporte un second éclairage. Une embolie trouve généralement sa source dans de gros caillots formés dans les jambes. Les travaux du CHRU Minjoz soutiennent que le Covid-19 provoque, en réalité, la formation d’une galaxie de minuscules caillots directement dans les petits vaisseaux des poumons.
Quels changements ?
Concernant la méthodologie d’examen à pratiquer en cas de Covid, ils sont fondamentaux. « Le propre de notre article, c’est de dire qu’il faut injecter tout le monde avec du produit de contraste. Car dès lors qu’on repère une embolie pulmonaire, c’est traitable », simplifie le Pr Delabrousse. Il suffit de placer le patient sous anticoagulant. De fluidifier son sang, pour permettre à l’oxygène de mieux circuler.
D’autres études, menées notamment aux États-Unis, allaient déjà dans ce sens en plébiscitant l’utilisation massive d’anticoagulants. « À Besançon, l’ensemble des patients Covid placés en réa sont désormais »anticoagulés » », abonde Eric Delabrousse. Tout comme au CHU de Strasbourg, également précurseur.
Quelles conséquences ?
L’article du CHRU de Besançon alimente un espoir réel, qui reste à démontrer scientifiquement : que la meilleure détection des embolies pulmonaires permette un traitement optimal de ce problème vasculaire, et fasse baisser le taux de mortalité globale du coronavirus. Même si par ailleurs, il restera à gérer l’infection des poumons, phénomène majeur et malheureusement déterminante dans les décès de patients.
Source : L’Est Républicain
Deux études françaises confirment l’embolie pulmonaire souvent associée au COVID-19
Une embolie pulmonaire aigüe est susceptible d’apparaître chez les patients atteints d’une pneumonie à COVID-19. Deux études françaises viennent confirmer ces résultats, l’une à Strasbourg, l’autre à Besançon.
Des cas d’embolie pulmonaire aiguë associés au COVID-19 ont été décrits dans la littérature dernièrement. Dans ce cadre, les niveaux de D-dimère ont été rapportés comme élevés chez les patients atteints par le virus, avec la suggestion d’une association entre la gravité de la maladie et le taux de D-dimère. Deux études françaises, publiées dans la Revue Radiology, viennent renforcer ces données spécifiques.
Taux de D-dimère et angioscanner thoracique pour 160 patients COVID+ strasbourgeois
C’est le cas tout d’abord d’une étude menée dans les unités de radiologie des Hôpitaux Universitaires de Strasbourg et coordonnée par le Pr Mickaël Ohana, dont le but est de décrire le taux d’embolie pulmonaire chez les patients COVID+ ayant subi une tomodensitométrie (TDM) thoracique dans un de ces centres. Du 1er au 31 mars 2020, des angioscanners ont été réalisés après l’injection de 50 à 75 ml de produit de contraste iodé à haute concentration, avec suivi de bolus et seuil de 160 HU à 250 HU dans l’artère pulmonaire principale. Les taux de fibrinogène et de D-dimère ainsi que les résultats de la réaction de polymérisation en chaîne par transcriptase inverse (RT-PCR) ont été enregistrés pour tous ces patients.
Lorsque la RT-PCR était négative, la TDM thoracique a été examinée par un radiologue thoracique principal pour rechercher des lésions caractéristiques du parenchyme pulmonaire COVID-19. Lorsque les images CT étaient considérées comme typiques et que les données cliniques étaient compatibles, le patient a également été jugé comme ayant COVID-19. 1696 patients ont ainsi fait l’objet d’une TDM pour suspicion ou suivi d’une infection à COVID-19. Des angioscanners ont également été réalisés chez 135/1696 (8%) patients, auxquelles ont été ajoutées des images de la phase artérielle pulmonaire incluses dans un scanner TAP sur 25 autres patients. Sur ces 160 patients, 106 patients ont été classés comme infection COVID-19 (97 patients par RT-PCR et 9 patients avec TDM positive et test RT-PCR négatif).
Les patients infectés par COVID-19 et présentant une embolie pulmonaire avaient des niveaux de D-dimère plus élevés que ceux sans embolie pulmonaire et ont été traités le plus souvent avec de l’héparine moléculaire avant l’angioscanner (25/32 (78%) contre 17/74 (23%). Chez ces patients infectés par le COVID-19, un D-dimère supérieur à 2660 µg/L avait une sensibilité de 32/32 (100%, IC à 95% 88-100) et une spécificité de 49/74 (67%, IC à 95% 52-79) pour embolie pulmonaire à l’angioscanner.
23% des patients COVID+ présentent une embolie pulmonaire aigüe à Besançon
Une autre étude, coordonnée par le Dr Franck Grillet au CHU de Besançon, L’objectif principal de notre étude était d’évaluer l’embolie pulmonaire en association avec une infection par COVID-19 en utilisant une angiographie pulmonaire par TDM. Les critères d’inclusion à cette étude rétrospective étaient des patients adultes consécutifs (≥ 18 ans) avec un diagnostic de COVID-19 par RT-PCR ou une forte suspicion clinique ayant fait l’objet d’une TDM thoracique injecté avec 60ml de produit de contraste à 4ml/S, entre le 15 mars et le 14 avril 2020 dans un seul centre.
Sur 2003 patients diagnostiqués COVID+, 100 ont été inclus. L’âge moyen était de 66 ± 13 ans, avec 70 hommes et 30 femmes. Sur des 100 patients, 23 avaient une embolie pulmonaire aiguë. Les patients avec embolie pulmonaire étaient plus fréquemment dans l’unité de soins intensifs que ceux sans embolie pulmonaire, nécessitant une ventilation mécanique plus souvent et avaient un délai plus long entre le début des symptômes et le diagnostic CT d’embolie pulmonaire (12 ± 6 contre 8 ± 5 jours), respectivement.
Au final, cette étude montre que 23% des patients COVID+ sont sujets à une embolie pulmonaire aigüe, le plus souvent associée à une ventilation mécanique invasive et au sexe masculin. Même si des marqueurs importants de cette pathologie, dont le taux de D-dimère, sont absents de l’étude, ces résultats suggèrent que les patients présentant des caractéristiques cliniques sévères de COVID-19 peuvent avoir une embolie pulmonaire aiguë associée. Par conséquent, l’utilisation d’une TDM injectée plutôt que d’une TDM sans contraste de routine peut être envisagée pour ces patients.
Source : Thema Radiologie
Embolie pulmonaire aiguë associée à une pneumonie COVID-19 détectée par angiographie pulmonaire par tomodensitométrie
Résumé
Chez les patients présentant des caractéristiques cliniques graves de l’infection par COVID-19, la proportion de patients présentant une embolie pulmonaire aiguë était de 23 % (IC à 95 % : 15 %, 33 %) lors de l’angiographie pulmonaire par tomodensitométrie.
Introduction
La tomodensitométrie thoracique joue un rôle important dans l’optimisation de la prise en charge des patients atteints de COVID-19 tout en éliminant les diagnostics alternatifs ou les pathologies supplémentaires, notamment pour l’embolie pulmonaire aiguë (1). Quelques études et cas cliniques isolés de pneumonie à COVID-19 avec coagulopathie et embolie pulmonaire ont été récemment publiés (2-4). L’objectif principal de notre étude était d’évaluer l’embolie pulmonaire en association avec l’infection par COVID-19 en utilisant l’angiographie pulmonaire par tomodensitométrie.
Matériels et méthodes
Cette étude rétrospective a été approuvée par notre conseil d’examen institutionnel. Elle a suivi les directives éthiques de la déclaration d’Helsinki. Il a été renoncé au consentement éclairé écrit. Trois auteurs (F.G., J.B., P.C.) ont eu accès aux données de l’étude. Aucun auteur n’a de conflit d’intérêt à déclarer en ce qui concerne cette étude.
Patients
Les critères d’inclusion étaient des patients adultes consécutifs (≥ 18 ans) avec un diagnostic par RT-PCR (kit du virus ARN NucleoSpin, Macherey-Nagel Inc., Bethléem, PA, USA) de SRAS-CoV-2 ou une forte suspicion clinique de COVID-19 (fièvre et/ou symptômes respiratoires aigus, exposition à un individu avec une infection confirmée par le SRAS-CoV-2) qui ont subi un scanner thoracique entre le 15 mars et le 14 avril 2020 dans un seul centre. Chez les patients présentant une infection suspecte ou confirmée par le CoV-2-SARS, la tomodensitométrie thoracique a été effectuée en présence de caractéristiques cliniques de la maladie grave (par exemple, nécessité d’une ventilation mécanique [VMI]) ou de comorbidités sous-jacentes). Les patients ayant subi un scanner thoracique sans contraste ont été exclus.
Protocole du CT
Notre protocole de routine pour les patients présentant des caractéristiques cliniques graves d’infection par COVID-19 était l’angiographie pulmonaire par tomodensitométrie multidétecteur en 256 tranches (Revolution, GE Healthcare, Milwaukee, WI) après injection intraveineuse de 60 ml d’agent de contraste iodé (Iomeprol 400 Mg I/mL, Bracco Imaging, Milan, IT) à un débit de 4 ml/s, déclenchée sur l’artère pulmonaire principale. Les paramètres du scanner étaient les suivants : 120 kVp, 80 x 0,625 mm, temps de rotation de 0,28 s, courant moyen du tube de 300 mA, pas de 0,992 et CTDIvol 4,28 mGy.
Analyse de l’imagerie. Le tracé du COVID-19 et la présence d’embolie pulmonaire ont été analysés indépendamment par deux radiologues thoraciques (J.B. et F.G. avec 11 et 6 ans d’expérience) sur une station de travail PACS (Carestream Health, Rochester, NY). Les lecteurs n’ont pas pu voir l’état du patient ni les caractéristiques cliniques et biologiques. En cas de discordance, une lecture simultanée pour parvenir à un consensus a été réalisée.
Analyse statistique
Les comparaisons entre les variables continues ont été effectuées à l’aide du test t de Student lorsque la distribution était normale. Les comparaisons entre les variables catégorielles ont été effectuées en utilisant le test du chi carré de Pearson ou le test exact de Fisher. Pour déterminer les facteurs cliniques associés à l’embolie pulmonaire, nous avons considéré l’étendue des lésions au scanner, la nécessité d’une ventilation mécanique invasive, la démographie et la présence de comorbidités comme des variables indépendantes potentielles dans un modèle de régression logistique. Une valeur P inférieure à 0,05 indique une différence significative. Toutes les analyses ont été effectuées avec la version 3.4.4 de R (équipe centrale R 2017).
Résultats
Sur 2003 patients diagnostiqués avec COVID-19, 280 patients ont été hospitalisés pendant la période d’étude. Parmi ceux-ci, 129 des 280 (46 %) patients hospitalisés ont subi un scanner à une moyenne de 9 ± 5 jours après l’apparition des symptômes. Vingt-neuf patients ont subi un scanner thoracique sans contraste en raison d’une contre-indication au contraste iodé ou de caractéristiques cliniques non graves et ont donc été exclus. Enfin, 100 patients atteints d’une infection par COVID-19 et présentant des caractéristiques cliniques graves ont été inclus et ont été examinés à l’aide d’une tomodensitométrie avec contraste. L’âge moyen des patients inclus était de 66 ± 13 ans, avec 70 hommes et 30 femmes (Tableau ; Annexe E1). Sur 100 patients répondant aux critères d’inclusion, 23 (23 %, [95 % IC, 15-33 %]) souffraient d’embolie pulmonaire aiguë (figure 2 ; annexe E1). Les patients souffrant d’embolie pulmonaire étaient plus souvent en unité de soins intensifs que ceux sans embolie pulmonaire (17 (74 %) contre 22 (29 %) patients, p<.001), avaient besoin d’une ventilation mécanique plus souvent (15 (65 %) contre 19 (25 %) patients, p<.001) et avaient un délai plus long entre l’apparition des symptômes et le diagnostic de l’embolie pulmonaire par tomodensitométrie (12 ± 6 contre 8 ± 5 jours, p<.001), respectivement (Tableau). Dans l’analyse multivariable, le besoin de ventilation mécanique (OR = 3,8 IC95% [1,02 – 15], p=0,049) est resté associé à l’embolie pulmonaire aiguë.
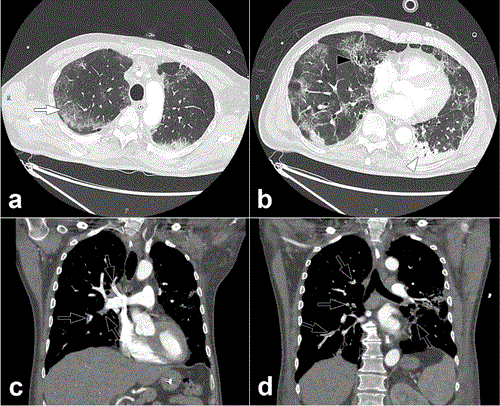
Figure 2 : Angiographie par tomodensitométrie pulmonaire d’un homme de 68 ans. Le scanner a été obtenu 10 jours après l’apparition des symptômes du COVID-19 et le jour où le patient a été transféré à l’unité de soins intensifs. Les images CT axiales (fenêtres pulmonaires) (a,b) montrent des opacités périphériques de verre au sol (flèche) associées à des zones de consolidation dans les parties dépendantes du poumon (pointes de flèche). Des réticulations interlobulaires, une bronchectasie (flèche noire) et une distorsion de l’architecture pulmonaire sont présentes. L’implication du volume pulmonaire a été estimée entre 25 et 50 %. Les reformations coronales du scanner (fenêtres médiastinales) (c,d) montrent une embolie pulmonaire bilatérale lobaire et segmentaire (flèches noires).

Discussion
Notre étude indique une prévalence élevée d’embolie pulmonaire aiguë chez les patients atteints de COVID-19 (23%, [95%CI, 15-33%]). L’embolie pulmonaire a été diagnostiquée en moyenne 12 jours après l’apparition des symptômes. Les patients souffrant d’embolie pulmonaire étaient plus susceptibles de nécessiter des soins dans l’unité de soins intensifs et de nécessiter une ventilation mécanique que ceux qui n’avaient pas d’embolie pulmonaire (Tableau).
Les lignes directrices actuelles (1,5,6) recommandent de réaliser un scanner thoracique sans contraste pour évaluer le schéma du scanner COVID-19 et son extension. Cependant, des rapports antérieurs suggéraient une coagulopathie associée à une infection par COVID-19 [par exemple (2,3)]. En outre, ces patients présentent des facteurs de risque fréquents d’embolie pulmonaire (par exemple, ventilation mécanique, admission en unité de soins intensifs). C’est pourquoi nous avons systématiquement effectué un scanner à contraste renforcé pour les patients atteints de COVID-19 présentant des caractéristiques cliniques graves afin d’évaluer le parenchyme pulmonaire ainsi que d’autres complications pouvant entraîner une détresse respiratoire.
Nos résultats ont montré des embolies pulmonaires fréquentes (23 %) chez les patients atteints de COVID-19. Dans une analyse multivariée, l’embolie pulmonaire a été associée à une ventilation mécanique invasive et au sexe masculin. Il est intéressant de noter que l’étendue des lésions n’était pas associée à l’embolie pulmonaire. Nous reconnaissons la nature préliminaire de ces résultats, y compris sa nature rétrospective et la taille limitée de l’échantillon. On ne disposait pas de marqueurs cliniques importants susceptibles d’expliquer ou d’être associés à l’embolie pulmonaire, notamment les D-dimères (seuls 22 patients sur 100 avaient des taux de D-dimères disponibles). Néanmoins, nos résultats suggèrent que les patients présentant des caractéristiques cliniques graves de COVID-19 peuvent avoir une embolie pulmonaire aiguë associée. Par conséquent, l’utilisation d’une tomodensitométrie à contraste renforcé plutôt que d’une tomodensitométrie de routine sans contraste peut être envisagée pour ces patients.
References
- 1. Revel M-P, Parkar AP, Prosch H, Silva M, Sverzellati N, Gleeson F et al. COVID-19 patients and the Radiology department – advice from the European Society of Radiology (ESR) and the European Society of Thoracic Imaging (ESTI). 2020;11. Google Scholar
- 2. Danzi GB, Loffi M, Galeazzi G, Gherbesi E. Acute pulmonary embolism and COVID-19 pneumonia: a random association? Eur Heart J. 2020 Mar 30;ehaa254. Crossref, Medline, Google Scholar
- 3. Xie Y, Wang X, Yang P, Zhang S. COVID-19 Complicated by Acute Pulmonary Embolism. Radiol Cardiothorac Imaging. 2020 Apr 1;2(2):e200067. Link, Google Scholar
- 4. Goeijenbier M, van Wissen M, van de Weg C, Jong E, Gerdes VEA, Meijers JCM et al. Review: Viral infections and mechanisms of thrombosis and bleeding. J Med Virol. 2012 Oct;84(10):1680–96. Crossref, Medline, Google Scholar
- 5. Simpson S, Kay FU, Abbara S, Bhalla S, Chung JH, Chung M et al. Radiological Society of North America Expert Consensus Statement on Reporting Chest CT Findings Related to COVID-19. Endorsed by the Society of Thoracic Radiology, the American College of Radiology, and RSNA. Radiol Cardiothorac Imaging. 2020 Apr 1;2(2):e200152. Link, Google Scholar
- 6. Rubin GD, Desai SR, Goo JM, Inoue Y, Tomiyama N, Ryerson CJ et al. The Role of Chest Imaging in Patient Management during the COVID-19 Pandemic: A Multinational Consensus Statement from the Fleischner Society.24. Google Scholar
Source : Radiology – 23-04-2020
Photo d'illustration: Le professeur Delabrousse (assis) et Paul Calame.
- Source : Les Crises